Organische Retrosynthese
Beschreibung
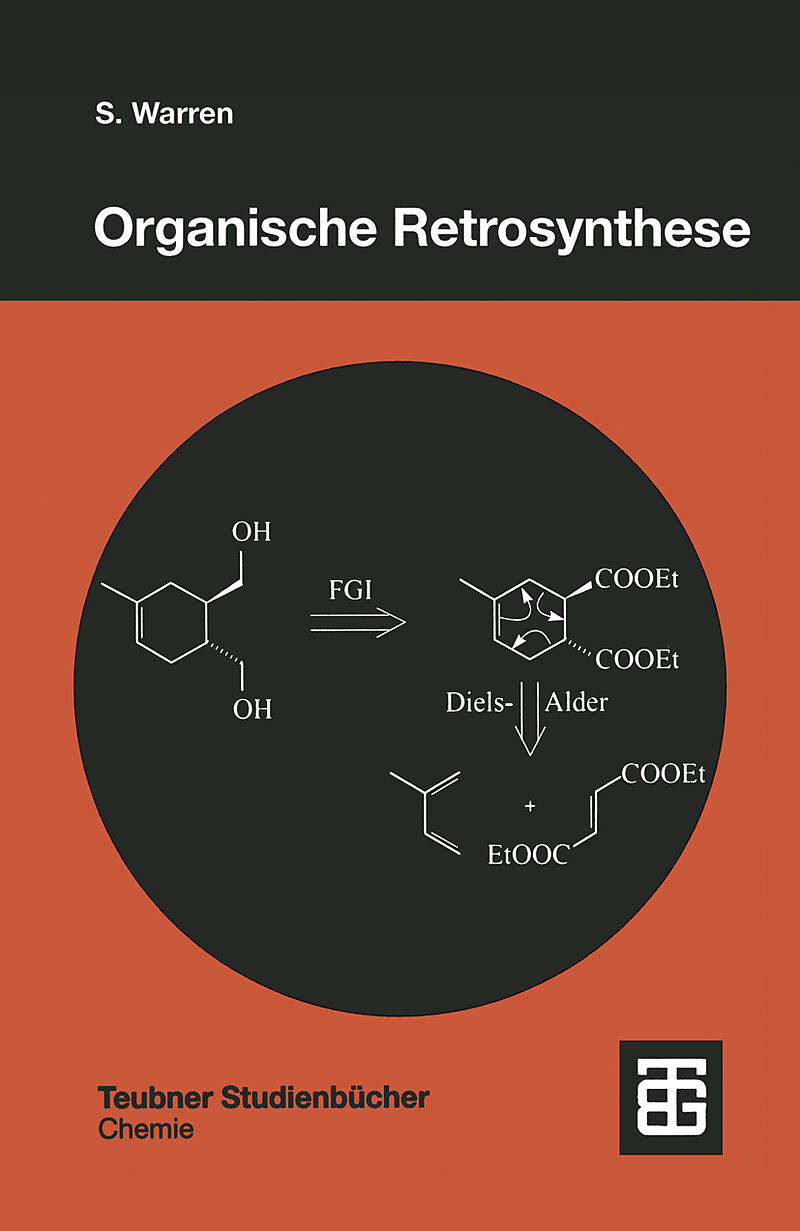
Dieses seit Jahren auf dem englisch-sprachigen Markt sehr erfolgreiche Buch bietet eine Einführung in die organische Retrosynthese und damit in die Syntheseplanung. Anhand von ca. 400 Lernschritten kann der Leser sich im Selbststudium die Grundlagen der Retros...Format auswählen
- Kartonierter EinbandCHF 82.40
- E-Book (pdf)CHF 66.90
Wird oft zusammen gekauft
Andere Kunden kauften auch
Beschreibung
Dieses seit Jahren auf dem englisch-sprachigen Markt sehr erfolgreiche Buch bietet eine Einführung in die organische Retrosynthese und damit in die Syntheseplanung. Anhand von ca. 400 Lernschritten kann der Leser sich im Selbststudium die Grundlagen der Retrosynthese aneignen. Dazu wird er mit einer Struktur (Zielmolekül) konfrontiert, deren Synthese er planen soll. Entscheidend ist dabei das Erkennen von "strategischen Bindungen" im Zielmolokül, durch deren Zerlegung aus dem Produkt kleinere Intermediate und Bausteine werden, die einem weiteren Retrosynthesezyklus unterworfen werden - so lange, bis man zu leicht erhältlichen Ausgangsmolekülen gelangt. Die sich im Buch jeweils anschließende Synthese zeigt dann, durch welche reale Reaktionssequenz das Molekül hergestellt werden kann. Zur Kontrolle und Vertiefung des Gelernten finden sich über das Buch verteilt Anwendungsaufgaben. Ziel ist es, dem Leser die Vorgehensweise bei der Retrosynthese zu vermitteln und ihn damit in die Lage zu versetzen, selbst für komplexe Moleküle Synthesen zu entwerfen. "... Grundsätzlich ist dieses Buch jedem Studierenden zu empfehlen, der sich vertiefter mit organischer Chemie befassen will, zumal der Preis wie bei fast allen Teubner-Buchern attraktiv ist." md+ml. Die Chemische Keule
Inhalt
Was müssen Sie wissen, bevor Sie beginnen?.- Wie man das Programm benutzt.- Warum sich mit Retrosynthesen herumquälen?.- A. Einführung in die Retrosynthese.- Lernschritte 1 9.- B. Retrosynthesen für Moleküle mit nur einer funktionellen Gruppe.- Lernschritte 10 83.- 1. Retrosynthesen einfacher Alkohole.- Lernschritte 10 22.- 2. Verbindungen, die sich von Alkoholen ableiten lassen.- Lernschritte 23 27.- 3. Anwendungsaufgaben 1 3.- Lernschritte 28 35.- 4. Retrosynthesen einfacher Olefine, Lernschritte 36 43.- 5. Retrosynthesen von Arylketonen, Lernschritte 44 48.- 6. Gesteuerte Synthesen, Lernschritte 49 60.- 7. Retrosynthesen einfacher Ketone und Säuren.- Lernschritte 61 72.- 8. Zusammenfassung und Wiederholung, Lernschritte 73 77.- 9. Anwendungsaufgaben 4 6.- Lernschritte 78 83.- C. Retrosynthesen unter Beteiligung zweier funktioneller Gruppen.- Lernschritte 84 130.- 1. 1,3-Dioxygenierte Verbindungen.- Lernschritte 84 111.- (a) ?-Hydroxycarbonylverbindungen.- Lernschritte 84 87.- (b) ?,?-ungesättigte Carbonylverbindungen.- Lernschritte 88 93.- (c) 1,3-Dicarbonylverbindungen.- Lernschritte 94 107.- (d) Anwendungsaufgaben 7 8.- Lernschritte 108 111.- 2. 1,5-Dicarbonylverbindungen.- Lernschritte 112 124.- (a) Die Mannich-Reaktion in der Retrosynthesen.- Lernschritte 122 124.- 3. Anwendungsbeispiele 9 11.- Lernschritte 125 130.- D. Unlogische Retrosyntheseschritte.- Lernschritte 131 209.- 1. 1,2-Dioxygenierte Kohlenstoffgerüste.- Lernschritte 131 170.- (a) ?-Hydroxycarbonylverbindungen.- Lernschritte 131 149.- (b) 1,2-Diole.- Lernschritte 150 157.- (c) Unlogische Elektrophile.- Lernschritte 158 166.- (d) Anwendungsbeispiele 12 13.-Lernschritte 167 170.- 2. 1,4-Dioxygenierte Kohlenstoffgerüste.- Lernschritte 171 193.- (a) 1,4-Dicarbonylierte Verbindungen.- Lernschritte 171 178.- (b) ?-Hydroxycarbonyl-Verbindungen.- Lernschritte 179 186.- (c) Andere unlogische Synthone.- Lernschritte 187 189.- (d) Anwendungsaufgaben 14 15.- Lernschritte 190 193.- 3. 1,6-Dicarbonylverbindungen.- Lernschritte 194 202.- 4. Anwendungsaufgaben 16 18: Synthese von Lactonen.- Lernschritte 203 209.- E. Allgemeine Anwendungsaufgaben.- Anwendungsaufgaben 19 23.- Lernschritte 210 219.- F. Pericyclische Reaktionen.- Lernschritte 220 233.- Anwendungsaufgabe 24.- Lernschritte 232 233.- G. Heteroatome und heterocyclische Verbindungen.- Lernschritte 234 272.- 1. Heteroatome, Ether und Amine.- Lernschritte 234 247.- 2. Heterocyclen.- Lernschritte 248 264.- 3. Aminosäuren.- Lernschritte 265 266.- 4. Anwendungsaufgaben 25 27.- Lernschritte 267 272.- H. Spezielle Methoden für kleine Ringe: 3- und 4-gliedrige Ringe.- Lernschritte 273 300.- 1. Dreigliedrige Ringe, Lernschritte 273 288.- 2. Vierringe.- Lernschritte 289 294.- 3. Anwendungsaufgaben 28 30.- Lernschritte 295 300.- I. Komplexere Anwendungsaufgaben.- Anwendungsaufgaben 31 34.- Lernschritte 301 308.- J. Strategien.- Lernschritte 309 390.- 1. Konvergente Synthesen.- Lernschritte 309 318.- 2. Strategische Planung der Retrosynthese.- Lernschritte 319 333.- (a) Bindungen von Kohlenstoffatomen zu Heteroatomen.- Lernschritte 319 328.- (b) Polycyclische Verbindungen Die Methode des gemeinsamen Atoms.- Lernschritte 329 333.- 3. Umfassende Betrachtung der möglichen Bindungsspaltungen.- Lernschritte 334 348.- 4. FGIs vor derersten Bindungsspaltung Die Kosten einer Synthese.- Lernschritte 349 354.- 5. Besonderheiten, die die Strategie beherrschen.- Lernschritte 355 370.- 6. Addition funktioneller Gruppen.- Lernschritte 371 383.- (a) Strategien für gesättigt Kohlenwasserstoffe.- Lernschritte 371 380.- (b) Addition funktioneller Gruppen an Intermediate.- Lernschritte 381 383.- 7. Moleküle, deren funktionellen Gruppen keine Beziehung zueinander aufweisen.- Lernschritte 384 390.- K. Vertiefung.- Lernschritt 391.- L. Wiederholungsaufgaben 1 10.- Lernschritte 392 411.- M. Strategische Probleme 1 7.- Lernschritte 412 419.- N. Probleme mit mehreren publizierten Lösungen.- Lernschritte 420 423.
Produktinformationen
Weitere Produkte aus der Reihe "Teubner Studienbücher Chemie"
Tief- preis
- Organische Retrosynthese
- Stuart (Prof.) Warren